在肿瘤免疫治疗的临床实践中,免疫细胞需要接收到足够强度和数量的激活信号才能有效攻击癌细胞,然而癌细胞表面天然存在的免疫识别信号通常极其微弱。如何引导免疫细胞实现对癌细胞的精准识别与高效清除,始终是全球肿瘤治疗领域亟待攻克的核心难题。近日,中国科学院分子细胞科学卓越创新中心韩硕研究团队在这一领域取得重大突破,提出了一种全新的肿瘤免疫治疗策略。
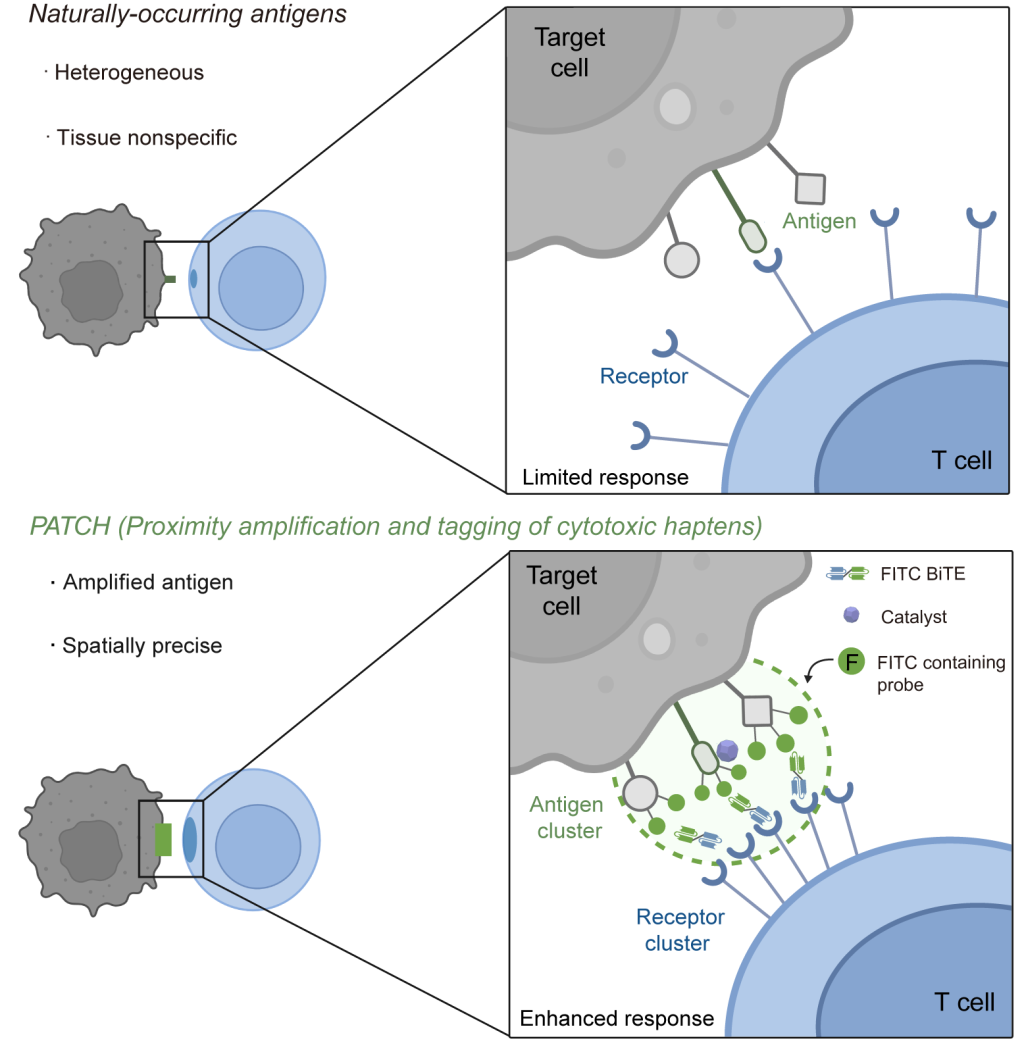
基于邻近标记的抗原扩增技术(PATCH)示意图 中科院分子细胞科学卓越创新中心 供图
该研究团队成功开发出一种以工程化纳米酶为核心载体的新型邻近标记技术,该技术在深红光或超声波的精准激发下,可在肿瘤细胞表面高效构建人工靶向位点,从而显著提升免疫细胞对癌细胞的识别精度和攻击效能。这项重要研究成果已于北京时间9月10日晚正式发表在国际顶级学术期刊《自然》(Nature)上,为全球下一代智能化、高效化肿瘤免疫疗法的研发开辟了全新路径。
从“微观观测”到“精准治疗”:技术跨界的革命性突破
邻近标记技术并非全新概念,其早期主要作为一种先进的“微观观测工具”应用于化学生物学领域的基础研究。作为一种强大的“分子图谱绘制技术”,它能够在细胞特定亚结构区域对周围生物分子进行催化标记,帮助科学家清晰解析特定分子在细胞内的相互作用网络,直观“洞察”生命活动的动态过程。
韩硕研究员在过往的科研工作中已对该技术的原理与应用有着深入的理解,他创新性地提出设想:既然邻近标记技术具备卓越的分子标记能力,能否通过技术改造使其从观测工具转变为主动干预细胞功能、解决临床难题的治疗手段?基于这一科学构想,研究团队成功研发出一种可响应深红光或超声波信号的工程化纳米酶。当这种纳米酶到达癌细胞附近并接收到红光或超声波传来的“标记指令”时,便能在癌细胞表面通过邻近标记的催化反应“原位构建”出高强度的人工靶向位点。随后,研究人员引入特制的双特异性T细胞衔接器(BiTE),该衔接器可同时识别癌细胞表面的人工抗原“补丁”与免疫T细胞,从而搭建起精准的攻击桥梁。
这种在癌细胞表面形成的高密度人工标记,不仅起到了精准指引的作用,更如同吹响了免疫攻击的“集结号”。它能有效促进T细胞表面相关识别受体的高效聚集与活化,触发T细胞进入“最强攻击模式”,对光或超声波精准定位的肿瘤部位实施高效且特异性的清除。小鼠实验结果显示,纳米酶被激发后的1至2天内,即可观察到肿瘤负荷相关指标的显著下降。
通过这一系列创新改造,邻近标记技术成功实现了从“观测工具”到“治疗武器”的跨界转变,韩硕团队的创新设想得到了有力验证。
激活全身性免疫应答并建立长期抗肿瘤记忆
更为重要的是,小鼠实验结果表明,通过在肿瘤部位人为构建不易被癌细胞逃逸的靶向位点,不仅有望解决当前免疫治疗中存在的靶点不足这一核心瓶颈,还能有效激发机体产生持久且强效的全身性抗肿瘤免疫效应。
当被标记的癌细胞被免疫细胞清除后,其内部的肿瘤特异性抗原等生物信息得以充分暴露。这些关键“情报”被免疫系统的抗原呈递细胞(即免疫系统的“情报部门”)捕获并呈递给全身免疫细胞,使免疫系统能够主动“学习”并识别此类癌细胞的特征。这意味着,即使身体其他部位存在未被标记的原发或转移同类癌细胞,经过“训练”的免疫系统也能对其进行精准识别与清除。
韩硕研究员进一步解释道,这种治疗策略不仅能够主动清除远处转移的癌细胞“同伙”,还能诱导免疫系统形成长期的免疫记忆。即便未来体内再次出现同类癌细胞,免疫系统也能迅速识别并将其清除,其效果类似于为机体接种了“个性化肿瘤疫苗”。
总体而言,这一创新性治疗思路具有双重优势:一方面,通过邻近标记技术实现了人工抗原的级联放大效应,显著增强了免疫杀伤的效率;另一方面,光或超声波的可控激发机制确保了纳米酶仅在肿瘤病灶部位被激活,有效避免了其对健康组织的非特异性作用,从而大幅降低了治疗相关的毒副作用。
目前,该研究已针对HER2、CD44v6等多个肿瘤相关靶点展开探索,涉及结直肠癌肝转移、乳腺癌、胃癌等多种常见肿瘤类型。在实验小鼠模型和体外临床肿瘤样本中,该治疗策略均展现出优异的抗肿瘤效果。研究团队表示,下一步将推进该技术在大动物模型中的临床前研究,并持续拓展更多类型的靶点分子和物理激发手段。
韩硕团队提出的这一创新策略为开发更智能、更高效的下一代肿瘤免疫疗法提供了重要理论基础和技术支撑。而邻近标记技术在医学领域的应用潜力远不止于此,未来有望在巨噬细胞激活、NK细胞功能调控、自身免疫性疾病治疗以及衰老细胞清除等多个领域探索更多创新性应用。
